公開日:2025.7.28(更新日:2025.8.26)

※ 本記事では「共焦点レーザー走査型顕微鏡」を「共焦点レーザー顕微鏡」と表記しています。
共焦点レーザー顕微鏡は、高い分解能(※1)を有し、三次元画像の構築が可能な光学顕微鏡(蛍光顕微鏡)の一種です。ワイドフィールド蛍光顕微鏡(※2)と比べて、コントラストが高く、ボケの少ないクリアな蛍光像を得ることができ、生物科学や医学などの研究に限らず、半導体検査などの産業分野においても活用されています。
この記事では共焦点レーザー顕微鏡の原理や関連技術、選定ポイントまで、幅広くご紹介いたします。研究や業務での共焦点レーザー顕微鏡の導入検討や活用にぜひお役立てください。
また、池田理化には顕微鏡専門の担当者も在籍しております。ご要望に合わせた最適な機器をご提案いたしますので、まずはお気軽にご相談ください。
共焦点レーザー顕微鏡について相談してみる
※1 分解能… 隣接した2つの点を、分離した2つの点として識別できる最小距離のこと
※2 ワイドフィールド蛍光顕微鏡… いわゆる「普通の蛍光顕微鏡」のこと。視野を一括で照明・撮影する方式のため、このように表現される。主に、共焦点レーザー顕微鏡などと同じ文脈で語られる際に、意味がぶれないよう区別するために用いられる。
目次
共焦点レーザー顕微鏡とは

共焦点レーザー顕微鏡(Confocal Laser Scanning Microscope:CLSM)は、特定の波長の励起光をサンプルに照射し、サンプルから発生する焦点位置の蛍光のみを観察・記録することのできる機器です。
励起光にレーザー光を用いることで狙った「点」に光を当て、さらに、発生した蛍光をピンホールと呼ばれる小さな穴を通して検出することで「焦点外の光を除去」します。このような仕組みにより、ワイドフィールド蛍光顕微鏡と比べてコントラストが高く、ボケの少ないクリアな蛍光像を得ることができます。
また、共焦点レーザー顕微鏡には、「共焦点顕微鏡」「コンフォーカル顕微鏡」などの別称があります。技術開発当時の共焦点光学系を用いた顕微鏡は、レーザー光を用いておらず、そのように呼ばれていましたが、現在の共焦点顕微鏡は、励起光にレーザー光を用いたものが主流となっています。
「共焦点レーザー顕微鏡(コンフォーカルレーザー顕微鏡)」の方がより厳密な呼称といえますが、「共焦点顕微鏡(コンフォーカル顕微鏡)」といえば「共焦点レーザー顕微鏡(コンフォーカルレーザー顕微鏡)」のことを指していると考えてほぼ差し支えありません。
共焦点レーザー顕微鏡の基本原理
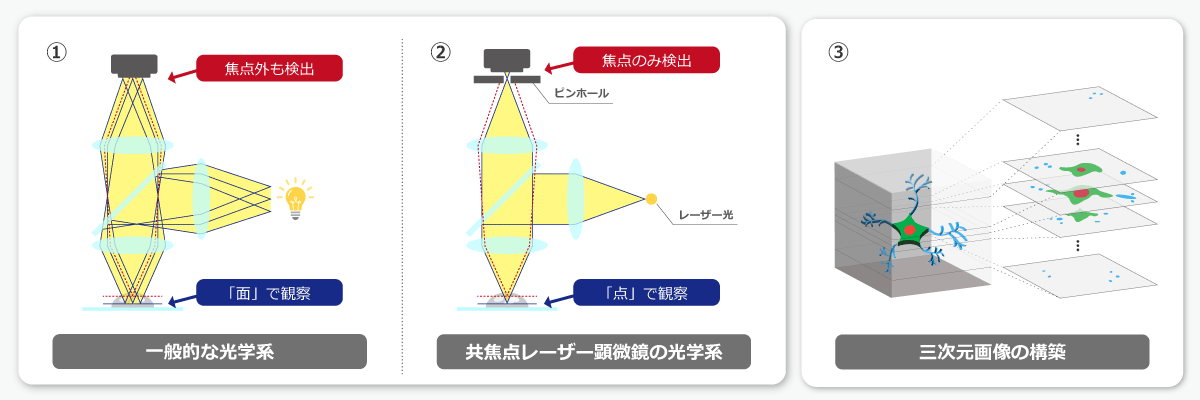
上図①のようにワイドフィールド蛍光顕微鏡は視野全体に励起光を照射し、焦点の合った「面」全体の蛍光を一度に観察します。しかし、ノイズとなる焦点外の蛍光も同時に検出してしまうため、分解能には限界があります。
一方、共焦点レーザー顕微鏡は、励起光に「レーザー光」を用います。上図②のように、レーザー光は指向性・収束性・直進性に優れており、正確に「点」に集光させることができます。さらに、発生した蛍光は「ピンホール」によって焦点外の光がカットされるため、焦点位置の「点」のみを選択的に検出することができます。このように、点光源とピンホールによって焦点位置の光のみを検出する光学系を「共焦点光学系(コンフォーカル光学系)」と呼びます。
共焦点レーザー顕微鏡による蛍光像は、そのような無数の「点」から構築されるため、スキャンに時間がかかりますが、ノイズとなる焦点外の蛍光が除去されるため、ワイドフィールド蛍光顕微鏡では観察しきれない細部まで詳細に観察することができます。
また、レーザー光は単一波長で高エネルギーなため、ワイドフィールド蛍光顕微鏡では難しい微弱な蛍光を検出することも可能です。
上図③のように観察面をZ軸方向にマイクロメートル単位でずらしていくことで、高精度な三次元画像(Zスタック画像)を構築することもできます。
共焦点光学系の種類
スキャン方式の違い
共焦点レーザー顕微鏡は、焦点位置の無数の「点」から画像を構築します。スキャン方式にはいくつかの種類があり、それぞれに異なる特徴があります。
ポイントスキャン型
一点ずつ励起光を照射し、ひとつのピンホールから一点ずつ蛍光を検出する手法です。
ガルバノミラー方式
ガルバノミラーの角度をモーターで制御することによってレーザーを走査させ、一点ずつスキャンする方式。
スキャン時間はかかるが、高感度・高分解能な画像を取得可能。高感度な検出器(GaAsPやMPPCなど)を用いることで、スキャン時間を短縮することも可能。ミラーの角度は自由に制御できるため、視野範囲を変更したり、観察したい任意の領域のみをスキャン(ROIスキャン)したりできる。
組織切片などの静止サンプルの詳細な形態観察に向いている。比較的汎用性が高く、生きた細胞をリアルタイムに観察するライブセルイメージング(生細胞観察)にも対応可能。
レゾナントスキャナ方式
レゾナントスキャナ(※3)を利用してレーザーを高速で走査し、一点ずつスキャンする方式。
ガルバノミラー方式と比べてノイズはやや多くなるが、スキャン速度に優れている。一点あたりの照射時間が短いため、サンプルへのダメージや褪色を抑えやすい。励起光の出力を下げ、複数回スキャンを積算することで、低光毒性・高感度を両立。蛍光強度が不足する場合は、高感度な検出器を併用することで対応できる。視野範囲の変更やROIスキャンには不向き、または非対応。
細胞内シグナルの研究など、短時間の変化を捉えなければならないライブセルイメージングに向いている。
※3 レゾナントスキャナ… 特定の周波数により一定の速度・振れ角で共振するミラーを搭載したスキャナのこと。一定の速度・振れ角だが、モーターによる角度調整よりも高速。
マルチポイントスキャン型
複数のピンホールにより、一点ずつではなく、多点同時に照射・検出を行う手法です。
※ デュアルディスクの場合
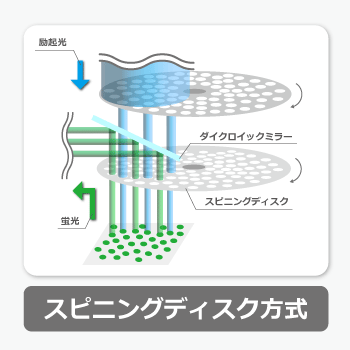
スピニングディスク方式
複数のピンホールの開いた円状のスピニングディスク(ニポウディスク)を回転させることで、スキャンを行う方式。
ディスクの種類を変更することで視野範囲の変更は可能だが、ROIスキャンには不向き、または非対応。
感度では前述のポイントスキャン型に劣るが、スキャン時間が短く、サンプルへのダメージや褪色を抑えやすいため、長時間のライブセルイメージングに用いられる。
走査方式の違い
スキャン方式の違いについては前述の通りですが、照射するレーザー光の走査方式にもふたつの種類があります。
レーザーを動かす「レーザー走査式」は高速スキャンが可能なため、ライブセルイメージングなどに向いています。
一方、レーザーを固定してサンプルの載ったステージを移動させる「ステージ走査式」は、高速スキャンでは「レーザー走査式」に劣りますが、位置再現性が高く、高精度な画像取得することが可能です。また、照射範囲の制約が少ないため、広範囲の観察や厚みのあるサンプルの三次元観察に向いています。
共焦点レーザー顕微鏡が活用される研究分野

共焦点レーザー顕微鏡は、高分解能かつ高コントラストな画像を得られるため、さまざまな分野で活用されています。
この章では、共焦点レーザー顕微鏡が活用される主な研究分野をご紹介します。
生命科学(生物科学・薬学・基礎医学など)
共焦点レーザー顕微鏡の主な用途は細胞や組織などの蛍光イメージングです。蛍光標識された特定の細胞や組織の構造や、タンパク質などの細胞内における局在を詳細かつ立体的に観察することも可能です。また、温度やCO2濃度を制御することで、生きた細胞を断続的に撮影(タイムラプスイメージング)したり、リアルタイムに観察(ライブセルイメージング)したりすることもできます。
生物科学においては、細胞内小器官(オルガネラ)や細胞骨格などの構造、細胞の発生過程、免疫細胞や神経細胞などの動態、微生物の挙動などの観察に用いられます。
薬学研究においては、薬物投与後の生体内分子の局在変化や、薬剤の生体内局在変化の解析、ドラッグデリバリーシステム(drug delivery system:DDS)の評価などに用いられ、創薬研究に活かされています。
また、医学研究においては、病理標本の観察、腫瘍微小環境やがん細胞の浸潤・転移の観察などに用いられ、診断や治療に役立てられています。
材料科学
共焦点レーザー顕微鏡は、透過性のあるサンプルであれば、内部構造を「非破壊」状態のまま観察することができます。
高分子材料の開発において、内部構造の詳細な三次元解析は重要であり、共焦点レーザー顕微鏡は古くから用いられてきました。また、半導体分野においても「非破壊」の高精度な形状測定に用いられています。
共焦点レーザー顕微鏡以外の顕微鏡との違い
この章では共焦点レーザー顕微鏡とよく比較される3つの顕微鏡について、共焦点レーザー顕微鏡との違いや用途を説明します。
それぞれの特徴を把握し、目的に合った観察手法を選択しましょう。
蛍光顕微鏡との違い
共焦点レーザー顕微鏡は蛍光顕微鏡の一種です。蛍光顕微鏡のうち、光学系に「共焦点光学系」、励起光に「レーザー光」を用いたものを「共焦点レーザー顕微鏡」と呼び、焦点位置の無数の「点」から観察像を構築します。
一方、いわゆる蛍光顕微鏡(ワイドフィールド蛍光顕微鏡)は、励起光に水銀ランプなどの「ランプ光」を用い、蛍光像を「面」で観察します。
分解能では共焦点レーザー顕微鏡に劣りますが、スキャン時間なしで視野範囲を一度に観察できる点が大きなメリットです。
共焦点レーザー顕微鏡で併用することもあり、ワイドフィールドイメージングで全体を撮影して、観察箇所を絞り込む際に用います。
ワイドフィールド蛍光顕微鏡については、以下の記事で詳しく紹介しています。
蛍光顕微鏡とは?原理や使い方・選ぶための6つのポイント
ライトシート顕微鏡との違い
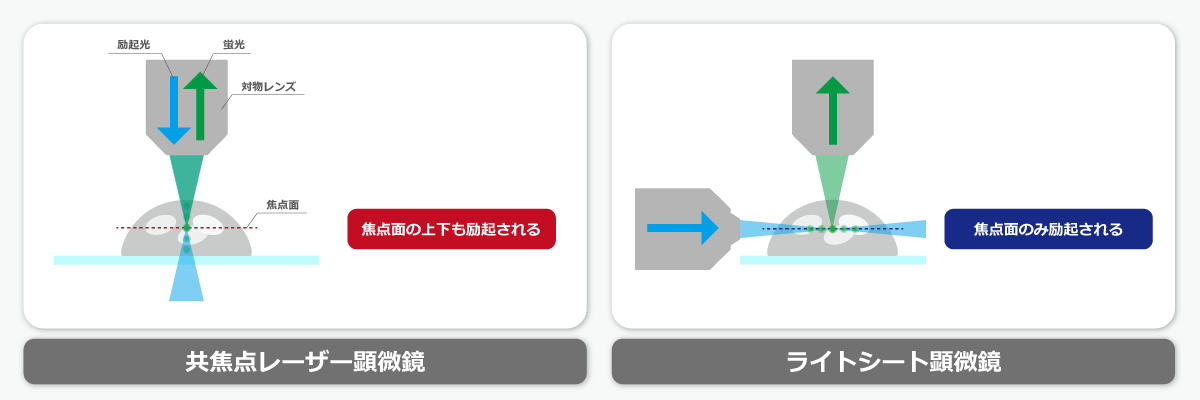
ライトシート顕微鏡は、励起光にシート状のレーザー光を用いる三次元画像の構築も可能な蛍光顕微鏡の一種です。
ライトシート顕微鏡は、上図右のように極薄いシート状の励起光をサンプルの側面から照射するため、観察面の上下に励起光が当たりません。
また、励起光の照射と蛍光の検出を異なる対物レンズで行います。このような仕組みのため、Z軸方向のボケが少なく、三次元観察を行うことが可能です。
観察したい面にのみ励起光が当たるため、サンプルへの不要なダメージが少ない点や褪色しにくい点も大きなメリットです。
共焦点レーザー顕微鏡と比べると、スキャン時間が短く済むため、原生生物の運動などの高速な現象の観察や、透明化したマウス脳のようにスキャン時間が膨大にかかる大型サンプルの撮影にも向いています。
以上のような特徴のあるライトシート顕微鏡ですが、分解能においては共焦点レーザー顕微鏡の方が優れています。これは、ライトシート顕微鏡の機構が高分解能な画像を取得するために必須となる高倍率・高NAの対物レンズに不向きなためです(※4)。このため、特に深部では光の散乱や減衰の影響も重なり、ボケが生じやすくなります。
また、サンプルに励起光が入る側と出る側では、出る側の方が画質でやや劣ります。
※4 ライトシート顕微鏡の機構が高倍率・高NAの対物レンズに不向きな理由
ライトシート顕微鏡は照射と検出を異なる対物レンズで行います。ところが、高倍率・高NA(※5)な対物レンズほど作動距離(※6)が短い傾向があり、対物レンズ同士が物理的に干渉してしまい、使用することができません。
※5 NA… Numerical Apertureの略で「開口数」のこと。明るさや分解能、焦点深度の深さを示すための指標で、NAが高いほど高い分解能を持つ。
※6 作動距離… 観察面に焦点を合わせたときの対物レンズからサンプル面までの距離のこと。
電子顕微鏡との違い
電子顕微鏡は、観察対象に電子線を当てることで拡大像を得る顕微鏡です。波長が短いほど分解能は高くなるため、光よりもはるかに波長が短い電子線を用いることで、光学顕微鏡よりも高分解能な画像を得ることができます。
ただし、電子顕微鏡による観察は、基本的に高真空下でサンプルを乾燥させて行う必要があり、基本的には生きた細胞などの湿潤なサンプルを観察することはできません(※7)。また、白黒で色の識別はできない点、サンプルの前処理や操作の難易度が高い点も考慮しましょう。
※7 補足:環境制御型走査電子顕微鏡(Environmental Scanning Electron Microscope: ESEM)のように、低真空下で湿潤なサンプルを前処理なしに観察可能な電子顕微鏡もある。
共焦点レーザー顕微鏡に関連する発展的な技術
さまざまな技術と組み合わせることで、共焦点レーザー顕微鏡の可能性は大きく広がります。この章では、共焦点レーザー顕微鏡に関連する発展的な技術についてご紹介します。
多光子励起
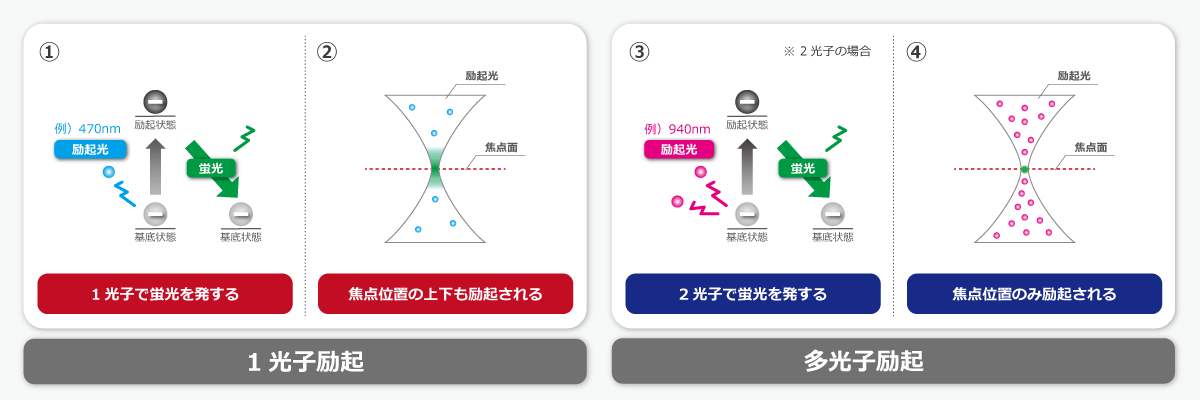
多光子励起とは、蛍光物質が通常の1光子のエネルギーではなく、1光子よりも低エネルギーな複数の光子のエネルギーを吸収することで励起される現象を指します。
光のエネルギー強度と波長は反比例しており、波長が長いほどエネルギー強度は弱くなります。たとえば、470nmの1光子で励起される蛍光物質を2光子励起する場合(上図①)は、2倍の波長である940nmの光子が2つ必要です(上図③)。
多光子励起は滅多に自然発生しませんが、光子密度の高い特殊なレーザー光源を用いることで人工的に発生させることができます。これを利用した顕微鏡が「多光子励起顕微鏡(2光子励起顕微鏡 ※8)」です。
多光子励起顕微鏡の最大の利点は「深部観察」にあります。長波長の光は短波長の光と比べて吸収や散乱が少なく、深部まで届きやすいうえ、焦点位置のみを励起するため、周辺への余計なダメージを抑えることができます(上図②、④比較)。
前述の「ライトシート顕微鏡」と比べるとスキャンに時間はかかりますが、より高分解能な三次元観察が可能です。
原理上、多光子励起顕微鏡に共焦点光学系は必須ではありませんが、両者を組み合わせた機種もあり、さらに高精細な深部観察が可能です。(多光子励起×共焦点光学系の機種は こちら )
※8 2光子励起顕微鏡… 記事公開日時点で、3光子以上を利用した多光子励起顕微鏡は一般的ではないため、多光子励起顕微鏡といえば、2光子励起顕微鏡のことを指していると考えてほぼ差し支えありません。
超解像技術(超解像イメージング)
光学顕微鏡の分解能の限界は約200nmとされており、それ以下の2点同士を識別して捉えることはできません。
その限界を超えた観察を可能とするのが「超解像技術」です。
ここでは、超解像イメージングに用いられる主な手法をご紹介します。
STED(Stimulated Emission Depletion: 誘導放出抑制)顕微鏡法
従来の共焦点レーザー顕微鏡に誘導放出抑制用のレーザー光(STED光)を搭載する。
通常、励起光によって励起状態になった蛍光物質は蛍光を発してから基底状態に戻る。ところが、励起状態の蛍光物質にSTED光を当てると、電磁波としてエネルギーが放出され(誘導放出)、蛍光を発することなく基底状態に戻る。これを利用して、左図のように点の中央周辺のみを基底状態に戻すことで、数十nmの分解能の超解像画像を実現する。
一般的には、光毒性の低さや画像取得速度では共焦点レーザー顕微鏡に劣るため、局所的な構造観察を詳細に行いたい場合に向いている。近年はそのようなデメリットをカバーする技術も普及しており、汎用性が高まっている。蛍光色素によっては不向きな場合もある。
基本的に共焦点レーザー顕微鏡と合わせて用いられる手法ではありませんが、超解像技術には下記のような手法もあります。
単一局在化顕微鏡法(Single-Molecule Localization Microscopy: SMLM)
ローカリゼーション法、1分子蛍光イメージングなどとも呼ばれる。2点として識別できないほど近接した2つの蛍光分子があったとき、これらを別々のタイミングで光らせることでそれぞれの位置を高精度に特定し、数十nmの分解能の超解像画像を実現する手法。
全反射蛍光(Total Internal Reflection Fluorescence: TIRF)顕微鏡と合わせて用いられ、表面近くの観察には有用だが、深部観察には不向き。複数画像から点描画のように全体像を構築するため、画像取得速度では共焦点レーザー顕微鏡に劣る。
光活性化局在性顕微鏡法(Photo-Activated Localization Microscopy: PALM)や確率的光学再構築顕微鏡法(Stochastic Optical Reconstruction Microscopy: STORM)はこの手法の一種。いずれの手法も強いレーザー光が必要な過程があるため、褪色や光毒性を考慮する必要がある。また、専用試薬が必要。
すべてのケースではないが、自発的に明滅する蛍光色素(High Molecular Specific Imaging of Receptors: HMSiR)を用いることで褪色や光毒性の影響を回避できる場合もある。
構造化照明顕微鏡法(Structured Illumination Microscopy: SIM)
ワイドフィールド蛍光顕微鏡と合わせて用いられる。ある規則的なパターンを持った照明(構造化照明)を当てることで、通常の観察では捉えられない一次回折光を取り込む。これによって得られる複数の「モアレ画像」から、画像演算によって超解像画像を構築する。
複数の画像から全体像を構築するため、画像取得速度では共焦点レーザー顕微鏡に劣るが、約2倍の分解能を得ることができる。
また、分解能ではSTED顕微鏡法や単一局在化顕微鏡法に劣るが、これらよりも画像取得速度が比較的速い。光学的な理論に基づいているため、単一局在化顕微鏡法で必要な専用試薬が不要で、操作性も高い。3次元画像の構築も可能。
高感度検出器とPSF補正による超解像技術
共焦点レーザー顕微鏡から得られた蛍光を、光子効率が高い高感度検出器を用いて検出し、点拡がり関数(Point Spread Function: PSF ※9)を用いることで超解像画像を取得する手法。各社で技術的な相違点はあるが、通常よりも高精度かつ広く光を集めて、PSFを用いて画像構築(デコンボリューション)する点が共通している。
ほぼリアルタイムに超解像画像を取得できることから、ライブセルイメージングや厚みのあるサンプルにも対応しやすいという利点がある。
※9 点像分布関数(PSF)… ひとつの点光源から得られる放射照度の分布のこと。点光源であっても、光学系を通した像は収差などの影響でボケのない理想的な“点”にはならずに広がってしまうため、PSFを用いてそれを排除する。
空間蛍光相関解析による超解像化(Super Resolution Radial Fluctuation: SRRF)法
2016年にNils Gustafssonらにより報告された手法。独自の空間相関および時間相関解析アルゴリズムに基づく超解像顕微鏡法で、研究や実用化が進んでいる。数十nmの分解能を有しながら、汎用性が高く、画像取得速度が速いことなどから注目されている。(SRRF法を用いた機種は こちら )
高度な蛍光イメージング技術
共焦点レーザー顕微鏡は高精度な蛍光画像を得られることから、高度な蛍光イメージング技術と合わせて用いられることも少なくありません。
下記でご紹介する手法にはレーザー光源が必要ですが、共焦点光学系は必須ではありません。いずれの手法も共焦点レーザー顕微鏡を使うとより高精度な観察が可能なため、共焦点レーザー顕微鏡でよく用いられています。
蛍光寿命イメージング顕微鏡法(Fluorescence Lifetime Imaging Microscopy:FLIM)
蛍光標識した分子の蛍光寿命(※10)を測定することで、その分子の周囲環境や分子間相互作用を捉えるための技術。
蛍光寿命は、分子結合や構造変化などの化学的な状態変化に依存するため、リアルタイムにモニタリングすることで、変化が起こったタイミングや反応の進行状況を把握することができる。
生物学的なプロセスの解析だけでなく、材料科学や化学分析などの分野でも活用されている。
※10 蛍光寿命… 蛍光が発せられてから消失するまでの平均時間
フェルスター共鳴エネルギー移動(Förster Resonance Energy Transfer:FRET)法
フェルスター共鳴エネルギー移動とは、二つの蛍光分子が近接することで、一方の分子からもう一方の分子へエネルギー移動が起きる現象のこと。このエネルギー移動は分子同士の距離が近くなると発生するため、分子間相互作用の解析に用いられる。
左図はこれを利用した手法のひとつ。分子間相互作用を解析したい二つのタンパク質A・Bを、それぞれドナー・アクセプターとなる蛍光物質で標識する。A・B間の距離が近づくと、ドナーからアクセプターへのエネルギー移動が発生し、それぞれの蛍光輝度が変化する。
主にタンパク質間の相互作用分析に用いられるが、材料開発の分野でも活用されている。
画像解析技術の進化
近年では、AI画像解析ソフトウェアを用いた観察・解析も普及しています。AIのディープラーニングを利用して「ノイズや褪色、光毒性を最小限に抑えるパラメータ調整」「画像セグメンテーション(※11)」「非染色培養細胞のデジタル染色」など、手間や時間のかかる作業を効率的に行うことができるようになりました。また、熟練した技術がなくてもハイレベルな解析ができることや、作業者ごとの主観によるばらつきが抑えられることも大きな利点です。
※11 画像セグメンテーション… 染色のばらつきや形状・サイズなどの類似性に基づいて個々の要素や領域に分割したり、観察対象と背景を分割したりする。ピクセル強度に基づく閾値処理よりも精度が高いとされる。
共焦点レーザー顕微鏡の使い方

共焦点レーザー顕微鏡は、ワイドフィールド蛍光顕微鏡と基本的な使い方は共通していますが、高精度なレーザー走査やピンホール調整などを行うため、多くのパーツが電動制御されています。そのため、ほとんどの操作はソフトウェアを介して行われ、その手順はそれぞれ異なります。
そこでこの章では共焦点レーザー顕微鏡の使い方の「コツ」についてご紹介します。
蛍光顕微鏡の基本的な使い方については下記の記事を参考にしてください。
蛍光顕微鏡とは?原理や使い方・選ぶための6つのポイント
パラメータ調整
蛍光は明るく撮れれば明るく撮れるほどよいというわけではありません。
画像の輝度値が飽和を起こしてしまう(サチュレーション)と、その部分の輝度値の勾配などの情報は失われてしまいます。
共焦点レーザー顕微鏡にはさまざまなパラメータがあり、それらを適切に調整することで高分解能・低ダメージ・高精度な観察を行うことができます。
- ピンホール径
小さくすると分解能は上がるが、蛍光強度は下がるため、小さくしすぎるとノイズが多くなってしまい逆効果。最初は1AU(※12)から始めるのがおすすめ。
- レーザー強度
強いほど感度は上がるが、ダメージや褪色の原因となる。また、強くしすぎるとノイズが多くなってしまうため、適切な強度調整が必要。適切な強度で複数回スキャンを積算した方がサンプルに優しい。最初は弱めから始めるのがおすすめ。
- 検出器の感度(ゲイン)
「ピンホール径は1AU程度/レーザー強度弱め」で、明るさはゲインで調整すると、褪色防止に繋がる。蛍光のシグナルが足りない場合、ゲインを高くすればシグナルは強くなるが、ノイズも増加するため、それぞれのバランスを見て調整する。
- スキャン速度
スキャンに時間をかけるほど感度が上がり、分解能も高くなる。その分、ダメージが蓄積し、褪色もしやすくなる点に注意。
- 解像度(画素サイズ)
解像度が高い(画素サイズが小さい)ほど、画像はきれいになるように思えるが、実際には各対物レンズの分解能を最大限発揮できる最適な画素サイズがある。分解能に対して、画素サイズが大きすぎると画像は不鮮明になり、画素サイズが小さすぎても分解能を超える情報は含まれない。最適な画素サイズは通常、分解能の1/2以下とされる。
ただし、高解像度にするとスキャンに時間がかかるため、スピードを優先したい場合は意図的に低解像度にすることもある。
※12 AU… Airy Unitの略。1AUは理想的なピンホール径を表す基準値のこと。
その他の注意点
使用後は各種装置の電源を落とし、清掃を行った後、カバーを付けて収納しましょう。なお、レーザーは非常に強い光のため、決して直視しないよう注意してください。
また、機器によって電源やソフトウェアの起動・シャットダウンのタイミングは異なる場合があります。順番を誤ると故障に繋がる可能性もあるため、しっかり確認しましょう。
共焦点レーザー顕微鏡を選ぶ7つのポイント

共焦点レーザー顕微鏡は、観察したいサンプルや目的によって最適な仕様が異なります。ここからは共焦点レーザー顕微鏡を選ぶ際の7つのポイントをご紹介します。
「本体の構造」や「蛍光キューブ」「光源」「対物レンズ」「カメラ(撮像素子)」の選び方についてはこちらの記事を参考にしてください。
蛍光顕微鏡とは?原理や使い方・選ぶための6つのポイント
1.サンプルの種類や撮影内容
サンプルの種類や撮影内容によって、必要となる仕様や機能は異なります。ここでは、大きく5つのパターンに分けて重視すべきポイントをご説明します。
共焦点レーザー顕微鏡による観察条件は複雑です。それぞれを組み合わせた条件の場合や、目的によっては、必ずしも下記の内容が最適ではない場合もあり得ます。
判断が難しい場合は、サンプルの種類と撮影したい内容を整理して、販売代理店やメーカーへ 相談 してみましょう。
① 組織切片などの静止サンプルを詳細に観察したい場合
静止サンプルの形態観察を行う場合、スキャンに時間はかかりますが、分解能が高く、汎用性の高い「ガルバノミラー方式」がおすすめです。
さらに高分解能な画像が必要な場合は、「超解像顕微鏡」を検討してもよいでしょう。
② 動態観察を行いたい場合
動態観察を行う場合、スキャンに時間がかかると、目的とする現象を捉え損ねる可能性もあります。したがって、このような場合には比較的スキャン時間が短く、画像取得速度が速い仕様を選ぶ必要があります。
ただし、スキャン時間を短くすると、画質が落ちる点に留意しましょう。どちらを優先すべきかは目的によりますが、「レゾナントスキャナ方式」は画質とスキャン時間のバランスが良く、ライブセルイメージングや高速の動態観察に向いています。
さらに短いスキャン時間が必要な場合は「ライトシート顕微鏡」を検討してもよいでしょう。
③ 生きたサンプルを長時間撮影したい場合
生きたサンプルを長時間撮影する場合、サンプルに合わせて温度や湿度、CO₂濃度を維持するための制御システムが必要です。
また、励起時間が長いほど、サンプルにダメージが蓄積し、蛍光も褪色していきます。このため、スキャン時間の短い「スピニングディスク方式」は長時間撮影に向いています。
長時間撮影の際は情報量も膨大になりますので、十分なデータ容量も用意しましょう。
④ 三次元観察を行いたい場合
三次元観察を行う場合、Zスタック撮影をするための制御システムが必要です。
三次元画像の構築におけるわずかな座標のズレは、全体の大きなズレに繋がってしまうため、座標位置の再現性と繰り返し精度の高さも重視しましょう。
「ステージ走査式」は位置再現性が高く、三次元観察に向いています。
三次元画像の構築には数百枚、何千枚の画像が必要となることもあるため、スキャン速度も重視するとよいでしょう。情報量も膨大になりますので、十分なデータ容量も用意しましょう。
また、共焦点レーザー顕微鏡は三次元観察が可能といっても、その深さ方向には限界があります。
脳神経細胞などの深部観察を行いたい場合は「多光子励起顕微鏡」もおすすめです。通常の共焦点レーザー顕微鏡と比べて、低光毒性で褪色しにくく、高分解能な深部観察が可能です。
透明化したマウス脳のようにスキャン時間が膨大にかかる大型サンプルの観察が行いたい場合は「ライトシート顕微鏡」を検討してもよいでしょう。
深部観察に特化するために、作動距離が長く、被写界深度(※13)の深い対物レンズもあります。組み合わせることでより効果的に活用できるでしょう。
13 被写界深度… ある一点に焦点を合わせたときに、同時にピントが合う深さ距離を示す指標のこと
⑤ 多色同時撮影を行いたい場合
複数の蛍光色素を同時に観察する場合、マルチチャンネル撮影が可能なシステムが必要です。
多色同時撮影では、蛍光色素の波長が被らないようにすることが重要です。そのため、UVから近赤外まで幅広い波長域に対応可能なシステムを選ぶとよいでしょう。近赤外域の撮影を行う場合は、最適化された対物レンズがあり、専用の検出器も必要です。
また、蛍光波長の分離精度が高いことも重要です。分離精度が低いと、クロストーク(※14)が発生してしまうことがあるためです。
※14 クロストーク… 多色同時撮影の際に、異なる蛍光色素間で励起スペクトルや蛍光スペクトルが重なることで、検出信号が混ざり合ってしまう現象のこと。
2.レーザーの種類
共焦点レーザー顕微鏡に必須となるレーザー光源は、非常に高価な機器です。
市販の蛍光標識試薬を用いる場合、目的の観察にマッチする試薬が豊富とは限りません。使いたい蛍光色素をあらかじめ明確にして、それに合わせて必要な波長のレーザーを選びましょう。
多色同時撮影を行いたい場合は、クロストークが発生しにくい蛍光色素の組み合わせを検討しておくとよいでしょう。
また、レーザーは日本産業規格「レーザー製品の安全基準(JIS C6802)」において、危険性の度合いに応じてクラス分けされています(※15)。クラスによっては、レーザー機器管理者の任命や、レーザー光線による障害を防止するための対策が必要です。
詳細な最新情報は「日本規格協会グループ」の該当規格や、厚生労働省が定める「レーザー光線による障害防止対策要綱」などを確認してください。
※15 レーザーのクラス… クラスは8段階(1/1M/1C/2/2M/3R/3B/4)に分類されており、クラスの数字が大きくなるほど出力が高く、人体への危険性も増す。
3.分解能の高さ
分解能の高さは、対物レンズの性能によって大きく変わります。同じ倍率であれば、NAの高いレンズほど分解能が高く、明るくクリアな像を得ることができます。
また、蛍光観察では特に、色収差(※16)の補正の有無が得られる像の質に大きく影響します。
ピンホールのサイズ調整をすることで、解像度や深さの精度を調整することができるため、サイズ調整機能の有無についても確認するとよいでしょう。
※16 色収差… 光がレンズを通過する過程で、波長(色)ごとの屈折率の違いにより、焦点位置がずれる現象のこと。
4.視野数の大きさ
視野数(Field Number:FN)とは、接眼レンズやカメラを通して観察できる「円形の視野の直径」のことです。視野数が大きいほど、一度に広い範囲の観察をすることができるため、作業効率が向上します。
たとえば、広い範囲をタイルのように繋げ合わせるタイリング撮影の際は、視野数が大きい方が必要枚数は少なく、次の撮影区画への移動距離が減るため、画像取得の時間が短くなります。
5.ソフトウェアの操作性
ソフトウェアが使いやすいかどうかは、作業効率に非常に大きく関わります。直感的な使いやすさや使用者との相性はデモで確認するとよいでしょう。
単純な使用感だけでなく、日常的な使用を踏まえて、作業の効率化に繋がる機能があるかどうかも重要です。
たとえば、プリセット機能があれば、観察条件に合わせて設定を保存できるため、次回以降の観察を迅速に行うことができます。
6.アフターサポートやメンテナンス性
研究の際は、観察手法が一般化されていないサンプルの観察を行うこともあるでしょう。このような場合には、メーカーのアプリケーションサポートが頼りになります。ご自身の目的とする観察に見識のあるメーカーを選んでもよいかもしれません。
日常的なメンテナンスの簡便性についても考慮しましょう。顕微鏡にとって、ホコリや汚れは天敵です。ホコリが溜まりにくい構造かどうか、クリーニングがしやすいかどうかについても確認しておくとよいでしょう。
顕微鏡のメンテナンス方法については、こちらの記事を参考にしてください。
蛍光顕微鏡とは?原理や使い方・選ぶための6つのポイント
また、共焦点レーザー顕微鏡はわずかなズレが大きなズレに繋がるため、定期的な点検も必要です。定期的に実施するキャリブレーションのしやすさや、メーカーによる保守点検のサポート体制についても確認しておきましょう。
7.拡張性
ルーチンワークではなく、さまざまな用途で使う可能性のある場合、拡張性があるかも選定時に重要なポイントです。レーザー光源の追加のしやすさや、スキャン方式の変更可否、超解像観察への対応可否など、必要な機能が追加可能な機種を選びましょう。
共焦点レーザー顕微鏡を選ぶ際には、サンプルの種類や撮影内容、分解能など、多くの要素を考慮する必要があり、どの機種が最適なのか迷うことも少なくありません。
池田理化では、長年の実績に基づく専門的な知識で、使用目的に最適な共焦点レーザー顕微鏡を選定するお手伝いをしています。また、顕微鏡専門の担当者も在籍しております。「共焦点レーザー顕微鏡の選定に悩んでいる」「目的に最適な機種を知りたい」という方は、ぜひ池田理化にご相談ください。