公開日:2024.10.7(更新日:2025.11.28)

HPLC(高速液体クロマトグラフ)は、液体に溶解している物質を分離・分析するための機器です。
この記事では、これからHPLCを使用する予定の方のために、機器の基本的な情報と使用方法についてご説明いたします。あわせてHPLCを選ぶ際のポイントも解説しますので、新規購入や買い替え時のご参考になりましたら幸いです。
HPLCについて相談してみる
目次
HPLC(高速液体クロマトグラフィー)とは

HPLCは「High Performance Liquid Chromatography」の略称で、液体クロマトグラフィーとも呼ばれる分析手法です。クロマトグラフィー(※1)の一種で、液体中の物質を固定相との相互作用の差によって成分ごとに分離します。
末尾の違いで、クロマトグラフィーは測定方法、クロマトグラムは測定結果、クロマトグラフは機器を指しますが、便宜的に機器を「HPLC」と呼んだり、「液クロ」という略称で呼んだりします。(※ 本記事では「HPLC」を機器呼称としても用いています)
また、HPLCと類似した名称に、LC(Liquid Chromatography)やUHPLC(Ultra High Performance Liquid Chromatography)があります。
LCは、メーカーによってHPLCやUHPLCを包括する意味合いで使われることもありますが、HPLCとUHPLCは明確に区別されており、UHPLCの方がより高い分解能を持ちます。
※1 クロマトグラフィー… 分離手法のひとつ。固定相への物質の吸着力の差を利用して、色々な物質が混ざった混合物から、純物質を分離する。
HPLCの使用目的
HPLCの使用目的は、サンプル中に含まれる複数の成分を、成分ごとに分離し、その分析を行うことです。
ろ過や蒸留などの古くからある手法と比較すると、1回の分析で複数の成分を高感度・高分離できる点が優れています。また、装置の構成やパラメータを変更することで、低分子・高分子、イオン性・非イオン性の物質まで、幅広いサンプルの分離・分析に対応可能です。
HPLCは、薬学分野における有効成分の検出、食品分野における栄養成分の抽出、異物混入の検出、その他農学・環境・工業化学など、幅広い分野の研究開発・管理等に使用されています。
HPLCとGC(ガスクロマトグラフィー)の違い
HPLCと近い分析手法にGC(ガスクロマトグラフィー)があります。
GCはHPLCと同様にクロマトグラフィーの一種ですが、分析対象が気体(ガス状物質または熱を加えることでガス化する物質)である点が異なります。また、HPLCが移動相に液体を用いるのに対して、GCでは気体を使用する点も違いといえるでしょう。
一方、GCの固定相は固体とは限らず、液体を用いる場合もあります。
HPLCの仕組みと原理

HPLCは、主に「送液ポンプ」「試料注入装置(インジェクター)」「検出器」から構成されます。また、使用時には「移動相」「固定相」も欠かせません。
「移動相」は「溶離液」とも呼ばれ、注入されたサンプルを運ぶ役割をする溶媒です。「固定相」はサンプル中の成分を保持する役割をしており、一定の特性を持つシリカゲルや樹脂などが充填された「カラム」がこれに当たります。
「送液ポンプ」は移動相を一定の流速に保って送る機器です。移動相は必要に応じて、移動相内に気体が残存しないよう「脱気装置」で処理されます。
「試料注入装置」からサンプルを移動相に注入すると、サンプルはチューブを介してカラムに到達し、カラムの内部で固定相との間に相互作用が起こります。固定相との相互作用が強い成分は遅く、弱い成分は速くカラムを通過するため、この速度差を利用してサンプル中の成分を分離します。また、条件によっては「カラムオーブン」を用いて、カラムの温度を一定に保つ必要があります。
最後に「検出器」で分離された成分が検知され、分析用ソフトウェアを搭載したPC(データ処理装置)によって分析データを出力する仕組みです。
HPLCの4つの分離方法
HPLCによる成分の分離方法は大きく4種類あります。ここでは「逆相クロマトグラフィー」「順相クロマトグラフィー」「イオン交換クロマトグラフィー」「サイズ排除クロマトグラフィー」について、それぞれの分離方法の特徴を違いや特徴をご説明します。
逆相クロマトグラフィー
HPLCで最も広く用いられる分離方式です。固定相と溶質の間に働く「疎水性相互作用」を利用して、分離を行います。
極性(※2)を持つサンプルが分析対象で、移動相を調整することで、水溶性サンプルにも疎水性(脂溶性)サンプルにも用いることができます。移動相には水やメタノール・アセトニトリルなどの極性の高い溶媒を使用します。
一方で、固定相には担体にアルキル基などを化学結合させた極性の低いものを用います。
極性の高い成分ほどカラムを遅く通過し、極性の低い成分ほど速く通過します。
※2 極性… 化学的に「極性がある」とは、原子間の結合や分子内での電荷に偏りがあることを指す。水は電気的に不安定で極性が高い物質。油は電気的に安定しており、極性がない物質である。
順相クロマトグラフィー
固定相と溶質の間に働く「親水性相互作用」を利用して分離を行う方法です。
移動相には低極性な溶媒、主にヘキサンなどの非極性溶媒とエタノールなどの極性溶媒を混合したものを用います。極性の高い成分の分析の場合には水を含む場合がありますが、基本的には移動相に水を含まないため、逆相クロマトグラフィーでは分離が困難な加水分解されやすい化合物や、脂溶性化合物の分離に向いています。
固定相には、多孔性シリカゲルやその表面にアミノプロピル基などの極性官能基を化学結合させた極性の高いものを用います。
極性の高い成分ほどカラムを遅く通過し、極性の低い成分ほど速く通過します。
イオン交換クロマトグラフィー
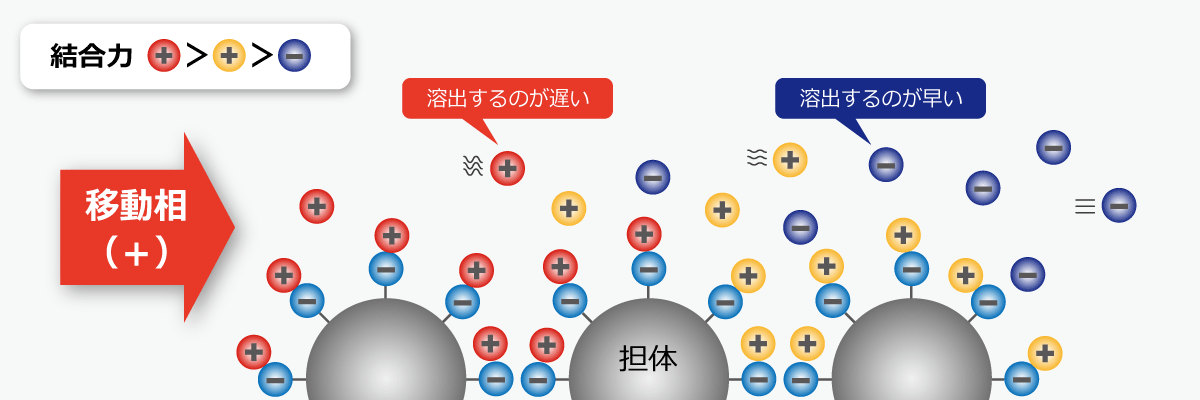
※陽イオン交換クロマトグラフィーの場合
固定相と溶質の間に働く「静電的相互作用」を利用して分離を行う方法です。
イオン化するサンプルが分析対象で、「陽イオン交換クロマトグラフィー」と「陰イオン交換クロマトグラフィー」の2種類があります。陽イオンの分析にはマイナスの電荷、陰イオンの分析にはプラスの電荷のイオン交換基が修飾された固定相が用いられます。
また、イオン交換基のイオン強度には強弱があり、分析対象となる成分の電荷や特性に合わせた選択が必要です。分析対象と同様に、移動相も固定相とは逆に荷電しているため、分離対象の成分と移動相のそれぞれが固定相に吸着・脱離を繰り返しながら、カラム内を移動していきます。
イオン交換基への結合力の強い成分ほどカラムを遅く通過し、弱い成分ほど速く通過します。また、対象成分のイオン価数によっても、固定相のイオン交換基への吸着に強弱が生まれ、分離スピードに差が生じます。同じ価数でも同族元素でイオン半径が小さいイオンほど、固定相への吸着は弱まり、溶出が早くなります。
サイズ排除(分子量分布)クロマトグラフィー
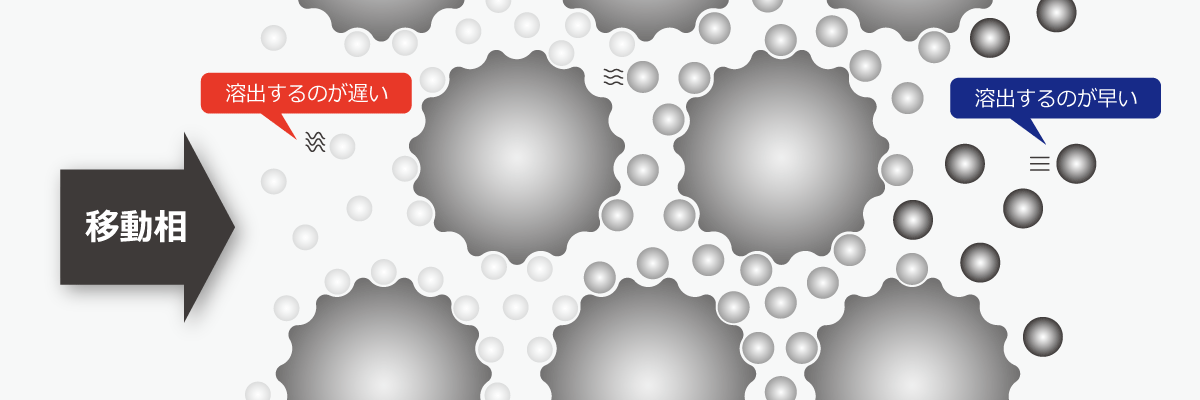
サイズ排除(分子量分布)クロマトグラフィー(Size Exclusion Chromatography;SEC)は、サンプルの分子サイズの違いを利用する分離方式です。
固定相には主に多数の細孔が開いた架橋体ゲルなどが用いられます。移動相がカラムを通過していく際、分子サイズが小さい成分ほど細孔の影響を受けて流れが遅くなり、分子サイズが大きい成分ほど速く通過することを利用して対象成分を分離します。
SECには大きく「ゲル浸透クロマトグラフィー(Gel Permeation Chromatography;GPC)」と「ゲルろ過クロマトグラフィー(Gel Filtration Chromatography;GFC)」の2種類があります。
GPCは「疎水性の固定相/非水系(有機溶媒)の移動相」を使用し、有機溶剤に可溶な合成高分子の検出などに用いられます。
GFCは「親水性の固定相/水系の移動相」を使用し、タンパク質などの水溶性の生体高分子の分離や、分子量測定に用いられます。
HPLCの検出器と検出可能物質
HPLCでは、目的に応じて複数の検出器を使い分けます。ここでは、代表的な3つをご紹介します。
- 紫外可視検出器
最も広く使用されている検出器。190nm〜900nm程度の波長の光をサンプルに照射し、透過した光を測定する。成分予測や純度チェック、サンプルの濃度測定など、幅広い用途で用いられる。
測定できるサンプルは色素・芳香族・タンパク質などのさまざまな吸光物質。UV/Vis検出器、紫外可視吸光度検出器などとも呼ばれる。
- 蛍光検出器
特定の周波数の光を照射することで発せられる蛍光を検出する。照射する波長ごとの蛍光強度(蛍光スペクトル)は物質特有なため、選択性に優れている。また、検出感度も高いため、微量の成分分析に向いている。
測定できるサンプルは発蛍光物質。「Fluorescence Detector」を略してFL検出器、FLR検出器、FLDなどとも呼ばれる。
- 示差屈折率検出器
サンプルと移動相の屈折率の違いを検出する。前述の2つに比べて感度は低いが、吸光性や蛍光性を持たない物質にも対応可能。
理論上、幅広いサンプルを検出できるため、ユニバーサル検出器とも称される。ただし、移動相の組成や温度が変化すると、屈折率も変化してしまうため、移動相が一定の組成であることと温度を一定に保つことが必須。移動相の組成が変化するグラジエント分析はできない。
「Refractive Index Detector」を略してRI検出器、RIDなどとも呼ばれる。
この他、任意の複数波長の吸光度を時間軸で測定可能な「多波長検出器(PDA検出器)」た、イオン化した成分の検出に適した「電気伝導度検出器」、酸化・還元など電気的に活性な成分の検出に適した「電気化学検出器」などがあります。
HPLCの定性分析と定量分析
HPLCでは定性分析(成分の判定)と定量分析(成分量の決定)、2種類の分析が可能です。

※ 定性分析の場合
定性分析では、標準試料とサンプルの分析を同一条件下で行います。
サンプルを分析して、標準試料と同じ時間にピークが認められれば、サンプル中に標準試薬と同じ成分が含まれている可能性が高いと判断することができます。他の成分と混同しないよう、移動相や固定相などの条件を変更して、複数回分析を行う必要があります。

※ 定量分析の場合
定量分析は、サンプルに含まれる対象成分の濃度を測定する方法です。
標準試薬を用いて左図の右上のような検量線を作成したのち、サンプルを同条件下で分析します。サンプルのピーク面積を標準試料と比較することで、サンプルの濃度を求めることができます。
HPLCの使用方法

HPLC(高速液体クロマトグラフ)の一般的な使用手順は以下の通りです。
- HPLCを構成する送液ポンプ、検出器などの各機器の電源を入れる
- 移動相の残量が十分であることを確認し、必要に応じて、脱気装置で移動相の脱気を行う
- ポンプの流速など、各機器のパラメータを設定する
- ポンプのパージ(呼び水動作)を行い、送液を安定化させ、流路を洗浄・均一化する
- 各機器の稼働が安定するまで30~60分程度待機し、安定化を確認する
- サンプルを試料注入装置(インジェクター)に注入し、測定を開始する
上記は一般的な手順であり、実際の操作方法は製品により異なる場合があるため、ご注意ください。
HPLCを選ぶ3つのポイント

HPLC(高速液体クロマトグラフ)はさまざまな機器から構成されています。この章では、それぞれの選定ポイントを順にご説明します。
最適なHPLCを選定するには、HPLCを構成する各種パーツを目的に合わせて選択する必要があります。池田理化では多くのメーカーの製品の中から適切なHPLCの組み合わせをご提案します。
HPLCについて相談してみる
1.送液ポンプのスペック
送液ポンプを選ぶ際のポイントは主に以下の3つです。
それぞれ順に見ていきましょう。
流量
HPLCの使用目的によって必要な流量は異なります。それぞれの目的に必要な流量の参考値は下記の通りです。
- セミミクロLC用 : 0.1~0.5 ml/min(※3)
- 分析用 : 0.3~10 ml/min
- セミ分取用 : 10~50 ml/min
- 分取用 : 50 ml/min 以上
※3 セミミクロLC… 同じ充填剤で通常サイズよりも内径の小さなカラムを用いることで、移動相の消費量を減らす手法のこと。内径が細くなる分、必要な流量は少なくなる。
送液方式
ポンプは吐出から吸引工程への切り替わりのタイミングにどうしても脈動が生まれてしまいます。しかし、送液の際に発生する脈動はHPLCの分析結果に影響を与えてしまうため、最低限に抑える必要があります。このため、HPLC用のポンプには主に「ダブルプランジャー方式」が用いられており、2つのプランジャーがお互いを補うような形で働きます。
この方式は主に下記の2種類に分けられ、以下のような特徴があります。
直列プランジャー方式
- 1台の送液ユニットの中に2つの異なるプランジャーが直列に配置されている
- 第一のプランジャーを第二のプランジャーが補正する役割を担う
並列プランジャー方式
- 1台の送液ユニットの中に2つの同じプランジャーが並列に配列されている
- サンプルは2カ所のポンプヘッドのいずれかを通過する
グラジエント分析の必要有無

「グラジエント分析」とは、移動相の混合比率を連続的に変化させながらサンプル中の成分を分離させる手法のことで、比率の調整には送液ポンプが用いられます。
出力の異なるポンプを並列運転で使用すると、圧力差が生じます。仮にポンプが2台あれば、この圧力差を利用して2液のグラジエント分析を行うことができます。移動相の混合は高圧下で行われるため、「高圧グラジエント」と呼ばれます。
また、電磁弁による制御により、1台で複数の液体を混合できる送液制御システムもあります。移動相の混合は大気圧下、すなわち、低圧下で行われるため、「低圧グラジエント」と呼ばれます。
それぞれのメリット・デメリットは以下の通りです。
- 高圧グラジエント
メリット :グラジエントの遅れが小さい
デメリット:混合したい移動相の数だけポンプが必要
- 低圧グラジエント
メリット :1台のポンプで複数の移動相の混合ができる
デメリット:電磁弁の開閉で混合比率を調整するため、プログラム上での設定に対して、実際の混合状態に遅れが生じる
目的とする分析に最適な移動相の混合比率を、手作業で探していくのは大変です。グラジエント分析は決まったプロトコルの分析を日常的に行う目的の場合には必要ありませんが、研究開発などにおいては重要なポイントとなるでしょう。
2.検出器の種類
HPLCの検出器には吸光度・蛍光・電気伝導度・示差屈折率検出器など複数の種類があり、検出できる成分や取得できるデータが異なります。分析対象に応じ、適切な検出器を使用しましょう。
紫外可視検出器では吸光物質が測定でき、多くのサンプルに対応可能です。蛍光検出器では蛍光物質の測定ができ、対象は限られますが高感度の検出が可能です。電気伝導度検出器は無機イオン、質量分布検出器はイオン性化合物の検出に適しています。また、示差屈折率検出器や蒸発光散乱検出器のように、ほぼすべてのサンプルを検出できる検出器もあり、これらはユニバーサル検出器とも呼ばれています。
「
HPLCの検出器と検出可能物質」の章も参考にしてみてください。
3.拡張性の有無
将来的に機能を拡張できるかどうかも重要なポイントです。
決まったプロトコルの分析を日常的に行うのであれば、一体型タイプのHPLCの方が安価で良いでしょう。一方で、研究開発では将来的に機能拡張が必要になる場合が多いです。
たとえば、分取を行う可能性のある場合は「フラクションコレクター」など、各種オートメーション機能への対応可否を確認しておきましょう。
また、既存機器のある場合に追加で新規購入を検討している場合は、既存機器とのデータの統合管理は可能かどうか確認しておくとよいでしょう。
将来的に分離した成分をさらに詳細に調べたいとい可能性のある場合には、MS(Mass Spectrometry、マス、質量分析計)との接続が可能かどうか、事前に確認しておくことをおすすめします。
HPLCの移動相(溶離液)・固定相(カラム)の選び方
HPLCは、移動相とともにサンプルが固定相を通過する際の相互作用の差を利用して、サンプルを成分ごとに分離・分析する仕組みです。このため、固定相や移動相が分析結果に与える影響は大きく、最適な固定相・移動相の選定は非常に重要です。
ここでは、固定相・移動相の選び方をご紹介します。
移動相(溶離液)の選定
移動相の組成は、保持時間(サンプルがカラムに入ってから溶離するまでの時間)が適切か、分離能やピーク形状が良好かなどを確認しながら検討することが大切です。また、サンプルの溶媒とあまりにかけ離れた組成の移動相は望ましくありません。
移動相には主に水、アセトニトリル、メタノール、ヘキサンやエタノールなどが用いられます。基本的には水と混合されることが多く、グラジエントをかけて混合比率を調整します。
一例として、アセトニトリルとメタノールの特徴を比較表にまとめました。このような特徴を理解して、それぞれのサンプルに最適な溶媒・組み合わせを検討することが重要です。
|
吸光度 |
カラム圧力 |
溶出力 |
粘性の変化 |
分離の選択性 |
緩衝液との混合による
析出の可能性 |
水との混合による
反応熱 |
| アセトニトリル |
低い |
低い |
大きい |
小さい |
化合物の特性による
|
高い |
吸熱 |
| メタノール |
高い |
高い |
小さい |
大きい |
低い |
発熱 |
固定相(カラム)の選定
HPLCの分離モードには逆相・順相・イオン交換・サイズ排除(分子量分布)があり、各モードに適したカラムを選定する必要があります。
まずは「HPLCの4つの分離方法」の内容を参考に、分析したいサンプルに最適な分離モードを選んでください。
ここでは、いずれの分離モードにも共通して言えるカラム選びのポイントについてご紹介します。
- カラムの太さ
固定相やカラム長、圧力などの条件を変えず、カラムの太さを変える場合、太いカラムよりも細いカラムの方が断面積当たりの濃度は高くなるため、検出ピークが高くなる。したがって、サンプルが貴重な場合は、カラムを細くすることで、少ないサンプルの量で分析を行うことができる。ただし、細いカラムにすることで、サンプルの濃度が高すぎて正しい分析が行えないこともあるため、適切な分量と濃度への調整が必要。
逆に、カラムを太くすると一度に多くのサンプルを流すことができるため、分取の効率が上がる。濃度に関しては、上述の内容と逆のことが言える。
- カラムの長さ
隣接するピークの分離が悪い場合は、カラムを長くすることで、サンプルが保持される回数が多くなり、分離度(※4)が上がる。その反面、分析時間が長くなり、ピーク形状が悪くなる可能性のある点に注意が必要。
※4 分離度(Resolution)… 2つの隣接するピークがどれくらい分離しているか示す指標となる値。完全に分離していると1.5以上となる。1.5より小さいほどピーク間の間隔が狭く、分離が悪い。
- 固定相(充填剤)の粒子サイズ
充填剤の粒子が大きいほどサンプルがカラム内を通過しやすく、分離対象となる成分が保持される回数が少なくなる。このため、分離度は下がるが、分析時間は短くなる。一方、粒子サイズが小さいほどサンプルはカラム内を通過しにくくなるため、分析時間はかかるが、分離度は上がる。
いずれの場合も、太ければよい・長ければよいといったことはなく、目的に合わせて最適なカラムを選ぶことが重要です。分析対象となるサンプルで、ピークが一番きれいに出て、最適な分離度となる条件を探しましょう。